¿Qué debe saber sobre gramos y moles y su cálculo?
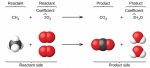
En la química analítica de cada nivel, debe comprender gramos, moles y conversión. Lo básico que se enseña en cualquier clase es moles. Sin lunares y su comprensión, no podrá comprender los conceptos avanzados de la química y sus aplicaciones. Echemos un vistazo más de cerca a estos conceptos:
¿Qué es el gramo?
Este es el sistema métrico para la unidad de masa. Se define como el peso absoluto de un volumen de agua pura que es igual al cubo de la centésima de metro [1 cm³] a la temperatura de fusión del hielo.
Unidades base SI: 10−3 kg
Unidades imperiales habituales: 0.0353 onzas
Sistema de unidades: unidad base UCUM y unidad CGS
Unidades CGS: 1 gramo
Unidad de: misa
1 g en: es igual a
Usos:
Se usa comúnmente en el cálculo de ingredientes domésticos no líquidos y en supermercados de todo el mundo.
Unidad de medida de la química topo básica:
Siempre ha sido mi materia favorita en la universidad y estoy seguro de que también te gusta calcular moles de diferentes compuestos. Es solo otra unidad de medida. Puede usar una mole fraction calculator para verificar instantáneamente la relación molar. Además, se desarrollan nuevas unidades cuando las anteriores ya no son adecuadas. Los cálculos químicos que involucran gramos fueron confusos al medir diferentes compuestos y productos químicos.
Si es estudiante y le resulta difícil calcular, la calculadora en línea grams to moles calculator le ayudará mucho con este problema.
El lunar también está hecho en algo reproducible. Un lunar es la cantidad de cualquier cosa que tenga el mismo número de partículas encontradas en los 12 gramos de carbono-12. Este número de partículas es el número de Avogadro, aproximadamente 6.02x1023. Un mol de átomos de carbono es 6.02 x 1023 átomos de carbono. Por lo tanto, es muy fácil escribir un mol en lugar de 6.02x1023 átomos de carbono. Hace que las cosas sean fáciles de convertir y comprender mientras se realizan largos cálculos.
Cálculo de moles en gramos.
Es uno de los cálculos de química más utilizados y cada persona debe calcularlo con precisión. De lo contrario, sus resultados serán muy inexactos. La relación molar entre reactivos y reactivos solo se usa después de verificar la theoretical yield calculator. Las masas atómicas son necesarias para esta conversión, que generalmente se obtiene de la tabla periódica. La mayoría de los estudiantes de química memorizan masas atómicas básicas. Sin ellos, son como cero en cualquier subárea de química. Echemos un vistazo a uno de los ejemplos simples que lo ayudarán a comprender fácilmente la conversión y su fórmula:
Ejemplo:
¿C uántos gramos de dióxido de carbono hay en 0.2 moles de CO2?
Veamos ahora las masas atómicas de carbono y oxígeno. Este es el número de gramos por mol de átomos.
El carbono (C) contiene 12.01 gramos por mol.
El oxígeno (O) contiene 16.00 gramos por mol.
Una molécula de dióxido de carbono contiene 1 átomo de carbono y 2 átomos de oxígeno, por lo tanto:
cantidad de gramos por mol CO2 = 12.01 + [2 x 16.00]
cantidad de gramos por mol CO2 = 12.01 + 32.00
número de gramos por mol CO2 = 44.01 gramos / mol
Simplemente multiplique este número de gramos por mol por el número de moles que tiene para obtener la respuesta final:
gramos en 0.2 moles de CO2 = 0.2 moles x 44.01 gramos / mol
gramos en 0.2 moles de CO2 = 8.80 gramos
Se recomienda que cancele ciertas unidades para darle la que necesita. En este caso, los lunares han cancelado el cálculo, dejándolo con gramos.
También puedes convertir gramos a moles. Ambos son intercambiables y no son muy difíciles. Prueba esto y espero que te sea muy fácil.

Soy investigador y escritor de contenido técnico. También he sido maestra de matemáticas desde 2007. Me gusta viajar, me encanta explorar nuevos lugares, personas y tradiciones. El fútbol es más que un deporte, el Real M




























Registro automático